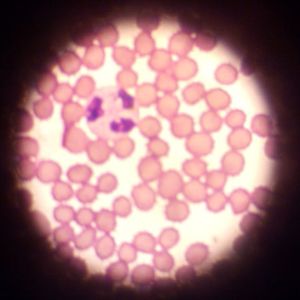
RECUENTO DE PLAQUETAS EN FROTÍS SANGUÍNEOS
INTRODUCCIÓN
El recuento de plaquetas (PLT o PLQ) consiste en la determinación del número de trombocitos en un volumen determinado de sangre (generalmente, en 1 mm3).
El recuento de plaquetas puede realizarse, de una forma aproximada, contando los trombocitos presentes en varios campos de una extensión sanguínea observada microscópicamente. Sin embargo, tambien se puede llevar a cabo un recuento de plaquetas más exacto, mediante el empleo de una cámara de recuento o, mejor aún, con contadores electrónicos de células.
El recuento de plaquetas practicadol mediante el examen de un frotis sanguíneo permite, además, el estudio de la morfología de los trombocitos.
METÓDICA
Material necesario
- Un microscopio.
- Papel.
- Un bolígrafo.
- Líquido de inmersión.
- Una extensión de la sangre problema coloreada con un método de tinción tradicional.
1º. Observar el frotis sanguíneo con el objetivo de inmersión del microscopio.
2º. Elegir, para su examen, una zona de la preparación sanguínea en la que las células no están superpuestas y en la que se observa la morfología de las mismas.
3º. Contar el número de plaquetas presentes en 10 cmpos microscópicos.
Para cambiar de campo correctamente y evitar contar los mismos trombocitos, se fija la vista en un punto de uno de los bordes del campo microscópico que se está estudiando (por ejemplo, el borde derecho) y se desliza el portaobjetos hasta que ese punto está en el borde opuesto de un nuevo campo microscópico (en este caso, en el borde izquierdo).
4º. Calcular la cifrea media del número de plaquetas contadas en los 10 campos microscópiccos.
Lectura de resultados
Para cuantificar, de una forma aproximada, el número de trombocitos comprendidos en uç1 mm3 de sangre, se aplica la siguiente fórmula:
PLT/mm3 = PLT/C x 20.000
PLT/mm3 = Número de plaquetas por mm3.
PLT/C = Media del número de plaquetas contadas en varios campos microscópicos (en este caso, en 10).
INTERPRETACIÓN CLINICA DE LOS RESULTADOS OBTENIDOS
Cuando se observa una extensión samguínea con el objetivo de inmersión, en condiciones normales, debe haber 1 plaqueta por cada 10-20 hematíes.
Esto equivale, aproximadamente, a la presencia, en una zona del frotis donde los eritrocitos no estan superpuestos, de 5 a 25 trombocitos por campo
Cuando el número de plaquetas `pr mm3 de sangre es inferior a 130.000, se dice que hay una trombocitopenia o trombopenia, y, cuando es superior a 400.000, se dice que hay una trombocitosis.
Hoja de trabajo
1º. En condiciones normales, ¿cuántas plaquetas por campo microscópico hay en una zona de un frotis sangíneo donde los eritrocitos no estan superpuestos?.
De 5 a 25 trombocitos por campo microscópico.
Resultados obtenidos
CAMPO
|
PLAQUETAS
|
1
|
5
|
2
|
5
|
3
|
7
|
4
|
4
|
5
|
10
|
6
|
14
|
7
|
10
|
8
|
19
|
9
|
11
|
10
|
12
|
97
|
PLT/C = 97/10 = 9,7 (media del
número de plaquetas contadas)
PLT/mm3 = PLT/C x 20.000 = 9,7 x 20.000 = 194.000 PLT/mm3
PLT/mm3 = PLT/C x 20.000 = 9,7 x 20.000 = 194.000 PLT/mm3
- Número de plaquetas contadas en 10 campos microscópicos....97 plaquetas.
- Media del número de plaquetas contadas en 10 campos microscópicos (PLT/C)....9,7 plaquetas.
- Número de plaquetas por mm3 de sangre (PLT/mm3)....194.000 plaquetas/mm3.
Valoración de los resustados
El PLT/mm3 obrtenido implica que el sujeto tiene: Un número de plaquetas normal.